Il faut évoquer une endométriose devant des algies pelviennes chroniques de la femme et la rechercher par une anamnèse orientée. L’arsenal thérapeutique repose sur la connaissance des mécanismes douloureux. La reconnaissance et la prise en charge de la douleur sont primordiales et ne sont pas subordonnées à un diagnostic étiologique. Éviter l’errance diagnostique permet de diminuer les phénomènes de réponse pathologique à la douleur. Référer les patientes en centre expert en cas de traitement réfractaire, de compression urétérale ou d’infertilité. Prendre en charge toutes les facettes de la maladie : l’endométriose maladie et l’endométriose comorbidité.
CE QUE NOUS FAISONS
Les algies pelviennes chroniques (APC) sont définies par l’existence de symptômes douloureux pelviens anormaux, spontanés ou provoqués, cycliques ou non cycliques. Cette définition inclut les dysménorrhées sévères, la dyspareunie profonde et tous les autres symptômes douloureux localisés dans les territoires neuroanatomiques référés du pelvis. Elles sont très fréquentes chez les femmes en âge de procréer (2/3 des femmes de la cohorte Constances) et un motif fréquent de consultation. Leur prise en charge peut s’avérer un véritable challenge dans la pratique quotidienne. Parmi les causes d’APC, l’endométriose est sur le devant de la scène depuis quelques années compte tenu de l’errance diagnostique.
Le principal outil diagnostique :
« les oreilles du praticien »
Afin de différencier les patientes atteintes d’endométriose maladie de celles qui ne le sont pas, le meilleur outil reste l’anamnèse de la patiente :
- Les douleurs sont sévères EN > 7 ;
- Elles impactent la qualité de vie (absentéisme, restriction de participation) ;
- Il s’y associe, selon la localisation des lésions, des dyspareunies profondes et des douleurs à la défécation et à la miction à recrudescence cataméniale ; c’est ce qu’on appelle les douleurs « localisatrices »1.
Existe-t-il un intérêt pour l’examen gynécologique pelvien ?
La HAS recommande la réalisation de l’examen pelvien y compris en soins primaires, à la condition que les opérateurs qui le pratiquent soient formés et expérimentés. L’information et le recueil du consentement sont absolument nécessaires, ce d’autant que l’examen peut être douloureux du fait même de la maladie endométriosique. Il n’est pas recommandé chez l’adolescente et est contre-indiqué chez la vierge.
- Le spéculum peut identifier des lésions d’endométriose sous la forme de nodule bleuté ou de fronce vaginale (Figure 1) situé au niveau du fornix vaginal, cette situation est rare mais pathognomonique.
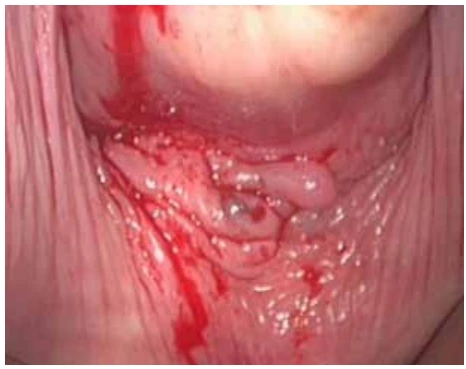
Figure 1 : Nodule bleuté du cul de sac vaginal postérieur.
- Le toucher vaginal permet d’objectiver un nodule ou une induration de l’aire rétro-cervicale (ligaments utéro-sacrés, torus, cul de sac de Douglas) (Figure 3), de rechercher des signes indirects : mobilité altérée de l’utérus, rétroversion utérine fixée et un syndrome myofascial (palpation douloureuse d’une zone gâchette musculaire au niveau de l’insertion des muscles).
Une échographie pelvienne est nécessaire afin d’éliminer des diagnostics différentiels. Cette échographie de première intention est susceptible de confirmer d’emblée l’existence d’une endométriose par la visualisation d’un kyste endométriosique au signal caractéristique avec une excellente sensibilité et spécificité. Ces kystes sont cependant présents dans moins d’un tiers des cas d’endométriose avérée et sont rares chez la femme jeune adulte. L’échographie de première ligne ne détecte que très rarement les autres formes de la maladie et une échographie négative ne doit en aucun cas faire rejeter le diagnostic.
En cas de signes localisateurs d’endométriose profonde, d’infertilité, d’endométriome ou de résistance au traitement médical, une imagerie réalisée par des référents est nécessaire : IRM et/ou échographie endovaginale2. Il existe une proportion de faux négatifs surtout pour les endométrioses superficielles, mais la causalité de l’association entre lésion invisible à l’imagerie et douleur est remise en question3. Les imageries de surveillance ne sont pas recommandées, l’histoire naturelle de la maladie n’est pas linéaire et l’évolution vers une aggravation n’est pas systématique.
Genèse de la douleur et thérapeutique
On explique la symptomatologie liée à l’endométriose par plusieurs mécanismes intriqués : sous l’influence des variations hormonales, les lésions d’endométriose saignent, eg endrant inflammation locale, péritonite chimique, puis fibrose et altérations de la plasticité des tissus, c’est ce que l’on appelle les douleurs nociceptives. Ces douleurs répondent en général très bien aux thérapeutiques médicales de première ligne. Les douleurs revêtant un caractère neuropathique peuvent être en rapport avec des lésions très profondes qui infiltrent ou enserrent les nerfs pelviens4.
La stratégie thérapeutique de première intention se base sur ces mécanismes physiopathologiques. Elle repose sur les AINS (p. ex., ibuprofène) qui, lors de la période de règles, contrôlent l’inflammation locale. Le traitement hormonal agit sur les micro-saignements au sein des lésions en provoquant une aménorrhée thérapeutique et régule la balance oestrogène/progestérone à l’origine de phénomènes douloureux. La HAS recommande :
- En 1re intention un oestroprogestatif discontinu ou continu (p. ex., Leeloo 0,1/0,02 mg) ou un DIU au lévonorgestrel 52 mg.
- En 2e intention un microprogestatif oral au désogestrel (p. ex., Désogestrel Teva 75 μg), le dienogest 2 mg (Dimetrum, Sawis), ou un implant progestatif (Nexplanon 68 mg).
Une réévaluation est recommandée à 3 mois pour la tolérance et à 6 mois pour l’efficacité. Les analogues de la GnRH ne peuvent être recommandés au long cours compte tenu des effets cardiovasculaires et de leur impact sur la masse osseuse ; leur prescription est l’affaire du spécialiste en cas de chirurgie ou de FIV.
La douleur pelvienne (liée ou non à l’endométriose) persistante dans le temps, active des circuits de renforcement de la douleur nociceptive locale, provoquant un phénomène de sensibilisation périphérique et central avec une extension au cours du temps de la douleur aux autres organes pelviens via un phénomène de sensibilisation croisée (cross sensitization)5. La sensibilisation centrale explique également l’association fréquente des douleurs présumées d’origine endométriosique à d’autres syndromes douloureux chroniques diffus (trouble fonctionnel intestinal, fibromyalgie).
Ainsi, il faut favoriser les traitements ayant un effet antisensibilisation et anti-hyperalgésiant tels que le paracétamol et le néfopam (Acupan, hors AMM). Les antidépresseurs ou les antiépileptiques sont des outils majeurs dans le cadre des douleurs neuropathiques. Éviter les opiacés, dont le tramadol, en dehors des crises qui, au-delà du risque de mésusage, favorise la dysfonction du système de régulation de la douleur et amplifie l’hypersensibilisation.
Les thérapeutiques associées sont également à considérer : neurostimulation électrique transcutanée (TENS), thérapie cognitive et comportementale (TCC), acupuncture et kinésithérapie en cas de syndrome myofascial.
Endométriose et adolescentes
L’endométriose est sans doute bien plus rare chez l’adolescente, mais on ne dispose pas de données consolidées en population générale. Néanmoins, la prévalence des dysménorrhées sévères chez l'adolescente est de 2 % à 29 % selon les cohortes étudiées : elles constituent un facteur de dé-sociabilisation majeure qu’il faut prendre en charge. Les principales causes dans cette population sont les dysménorrhées essentielles, les malformations utérovaginales (associées à des malformations rénales) ainsi que les ménorragies. Plus les règles sont abondantes plus les dysménorrhées sont sévères, il est essentiel d’évaluer l’abondance des saignements (score de Higham) et de proposer une prise en charge adaptée en se basant sur une contraception oestroprogestative de deuxième génération faiblement dosée en oestrogènes ou bien des microprogestatifs.
Endométriose et fertilité
On retrouve des lésions d’endométriose chez les patientes infertiles dans 35 % à 50 % des cas. Cette association n’est pas systématique et on conseille aux patientes une tentative de grossesse spontanée pendant 6 à 12 mois en fonction de l’âge, avant de réaliser un bilan standard d’infertilité et de les orienter vers une prise en charge spécifique en AMP. Les patientes présentant des endométriomes volumineux bilatéraux peuvent être référées en vue d’une cryoconservation ovocytaire, compte tenu de l’effet délétère sur la réserve ovarienne.
Diagnostics différentiels
Endométriose ne signifie pas forcément douleur ou infertilité : on retrouve dans une cohorte prospective de patientes asymptomatiques et fertiles opérées pour ligature tubaire une prévalence de 43 % de lésions d’endométriose visibles en per opératoire. L’association entre les lésions d’endométriose et la douleur n’est pas totalement élucidée. Il faut distinguer l’endométriose « histologique » – localisation ectopique de tissu endométrial au sein de la cavité abdominale – de l’endométriose « maladie » qui associe à cette lésion une symptomatologie évocatrice et une réponse aux thérapeutiques (Figure 2)6.
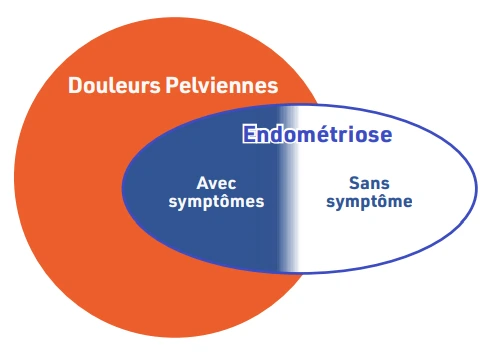
Figure 2 : Modèle de Hurd. Une partie des douleurs pelviennes chroniques ne sont pas considérées comme directement dues à l’endométriose.
La stratégie diagnostique proposée permet d’éliminer les autres causes d’APC. L’imagerie met en évidence une masse pelvienne, des myomes ou une adénomyose interne. Cette dernière concerne 21 % des femmes, et associe aux douleurs des ménométrorragies. Elle est fréquemment associée à de l’endométriose et peut majorer la symptomatologie douloureuse.
L’examen clinique peut retrouver des douleurs myofaciales, une malformation utérovaginale ou une infection génitale.
L’interrogatoire oriente vers un trouble fonctionnel intestinal, une constipation ou une maladie inflammatoire chronique intestinale (maladie de Crohn ou rectocolite hémorragique).
En cas d’exploration de première intention normale et de nonréponse aux thérapeutiques hormonales, on pourra évoquer un syndrome de congestion pelvienne (varices pelviennes responsables de douleur se majorant à la station debout), une cystite interstitielle (envie douloureuse d’uriner soulagée par la miction, pollakiurie sévère, ECBU négatif et cystoscopie évocatrice) ou encore une fibromyalgie.
Enfin, la dysménorrhée primaire pourra être retenue en cas d’explorations normales et de réponse aux thérapeutiques.
Quand référer ?
Référer à un centre expert en cas de :
- Douleurs persistantes malgré un traitement hormonal bien conduit > 6 mois,
- Atteinte urétérale à risque de retentissement rénal,
- Infertilité.
Une prise en charge chirurgicale et/ou en PMA sera discutée (Figure 3).
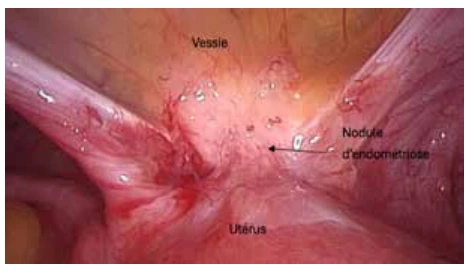
Figure 3 : Vue coelioscopique d'un nodule d’endométriose antérieure.
Gérer l’incertitude en soin
Les médecins ont besoin de diagnostiquer pour soigner et pourtant soigner c’est avant tout soulager. Il ne faut pas oublier que 30 % des patientes ont des symptômes sans diagnostic fixe.
Le problème c’est la douleur et son impact sur la qualité de vie. Il faut proposer aux patientes une prise en charge globale centrée sur la gestion de la douleur et associée à des modifications de style de vie. L’information des patientes est essentielle, notamment en s’aidant d’associations de patientes.
CE QUI CHANGE
Les femmes souffrant de formes sévères d’endométriose impactant la qualité de vie ont accès à la prise en charge à 100 % au titre de l'ALD 31 (affection hors liste des 30 ALD).
La notion d’endométriose « comorbidité » découle de l’association significative retrouvée entre endométriose et MICI (SIR = 1,8), syndrome de l’intestin irritable (OR = 3,5), maladie coeliaque (HR = 1,39) et migraine (OR = 1,22). Il est nécessaire de garder une approche globale de la patiente.
Les recommandations de l’ESHRE de 2022 ont placé le diénogest en première ligne de la séquence thérapeutique au vu des données de qualité de vie sur le long terme et de l’efficacité dans la diminution du volume des endométriomes7.
CE QUE NOUS FERONS
Le diagnostic d’endométriose s’enrichit du développement de modèles diagnostiques basés sur l’interrogatoire médical Chapron8 ou via un auto-questionnaire, par exemple de Nnoaham9, ainsi que de biomarqueurs salivaires (Endotest) permettant le diagnostic d’endométriose. Une autorisation en accès précoce dans le cadre du forfait innovation est prévue à la rentrée au sein des établissements hospitaliers10. Ces outils prometteurs nécessitent une validation pour démontrer leur utilité en pratique courante.
La stratégie nationale de lutte contre l’endométriose prévoit le recours à des filières de prise en charge graduée en fonction du niveau de soin requis afin d’améliorer le parcours de soin. En pratique il s’agit d’aider les acteurs de soins, via un maillage territorial, à prendre en charge les patientes et à adresser celles qui en ont besoin.
Conclusion
- CE QUE NOUS FAISONS
Le diagnostic d’endométriose repose sur l’anamnèse associée à une imagerie évocatrice. Entendre et soulager la douleur est essentiel et constitue le pilier de la prise en charge. - CE QUI CHANGE
La reconnaissance par les pouvoirs publics de cette maladie au travers de la stratégie nationale de lutte contre l’endométriose avec une intégration à la liste des ALD 31. - CE QUE NOUS FERONS
Le délai au diagnostic d’endométriose pourrait se voir réduit grâce à des outils numériques et des biomarqueurs salivaires qui sont en cours de validation.
Dr Yasmine Drouiche, Pr Arnaud Fauconnier
Service de Gynécologie et Obstétrique
CHI Poissy-St-Germain, Poissy.
Les auteurs déclarent ne pas avoir de lien d’intérêt
Références
- Fauconnier A, Chapron C, Dubuisson JB, Vieira M, Dousset B, Bréart G. Relation between pain symptoms and the anatomic location of deep infiltrating endometriosis. Fertil Steril. 2002; 78: 719–26.
- Haute Autorité de Santé. Prise en charge de l’endométriose. https://www.has-sante.fr/jcms/c_2819733/fr/prise-en-charge-de-l-endometriose
- Roynard T, Fauconnier 1, Fritel X, Le traitement chirurgical est-il efficace sur les douleurs liées à l’endométriose invisible à l’imagerie ? EM-Consulte. 2024; 8463: 301–380.
- Anaf V. Preferential infiltration of large bowel endometriosis along the nerves of the colon. Hum Reprod. 2004; 19: 996–1002.
- McNamara HC, Frawley HC, Donoghue JF et coll. Peripheral, central, and cross sensitization in endometriosis-associated pain and comorbid pain syndromes. Front Reprod Health. 2021; 3: 729642.
- Hurd WW. Criteria that indicate endometriosis is the cause of chronic pelvic pain. Obstet Gynecol. 1998; 92: 1029–32.
- Casper RF. Progestin-only pills may be a better first-line treatment for endometriosis than combined estrogen-progestin contraceptive pills. Fertil Steril. 2017; 107: 533–6.
- Chapron C, Lafay-Pillet MC, Santulli P et coll. A new validated screening method for endometriosis diagnosis based on patient questionnaires. EClinicalMedicine. 2022; 44: 101263.
- Nnoaham KE, Hummelshoj L, Kennedy SH et coll. Developing symptom-based predictive models of endometriosis as a clinical screening tool: results from a multicenter study. Fertil Steril. 2012; 98: 692–701.
- Bendifallah S, Dabi Y, Suisse S et coll. Validation of a salivary miRNA signature of endometriosis - Interim Data. NEJM Evid. 2023; 2: EVIDoa2200282.