Les principales arthrites microcristallines rencontrées en pratique courante sont la goutte, liée à des dépôts de cristaux d’urate monosodique, et la chondrocalcinose articulaire désormais dénommée rhumatisme à cristaux de pyrophosphate de calcium, liée aux dépôts des cristaux du même nom1,2. Dans les deux maladies, les cristaux sont responsables d’une réaction inflammatoire systémique se manifestant par des épisodes d’arthrites aiguës ou chroniques très invalidantes et s’associent à un surrisque cardiovasculaire médié par cette inflammation. Pour la goutte, il s’agit de la cause la plus fréquente d’arthrite au monde et, pour la chondrocalcinose, très certainement de la cause la plus fréquente après 60 ans.
GOUTTE
CE QUE NOUS FAISONS
« Ce que nous faisons » pour l’heure n’est malheureusement pas très glorieux, puisque la goutte est largement sous-traitée, malgré sa simplicité de prise en charge, et la chondrocalcinose est à peine diagnostiquée, notamment dans sa forme chronique, souvent prise pour autre chose.
Diagnostic de la goutte en pratique courante
La goutte est rarement un challenge diagnostique par sa présentation typique, avec des crises inaugurales caractéristiques dans leur brutalité, intensité et caractère inflammatoire local, qui touchera initialement la première articulation métatarsophalangienne (base de l’hallux) ou le tarse (cou-de-pied). Des périodes complètement asymptomatiques succéderont à ces crises. Après quelques années, la présentation clinique sera moins caractéristique, avec des douleurs subintrantes et des crises moins franches, avec une atteinte articulaire pouvant s’étendre au-delà des membres inférieurs.
Pour établir le diagnostic, la présentation clinique typique associée à une hyperuricémie (dosée en dehors de la crise, car elle peut être normale pendant) au-delà de 360 μmol/L (60 mg/L) sera souvent suffisante. Une certitude totale est apportée par la preuve (souvent par analyse du liquide articulaire) de la présence de cristaux d’urate monosodique3.
CE QUI CHANGE
De nouveaux moyens diagnostiques
Dans les cas diagnostiques difficiles, deux moyens d’imagerie tiennent le haut du pavé pour apporter la preuve non invasive de la présence de cristaux d’urate monosodique dans les articulations : l’échographie articulaire et le scanner double énergie, tous deux de recours spécialisé. En médecine générale, leur nécessité est exceptionnelle
Une prise en charge facile et de mieux en mieux codifiée
Le principe du traitement de la goutte n’a pas changé depuis des décennies, mais il n’a jamais été intégré ni appliqué par le plus grand nombre. La faute en partie à l’image péjorative d’une maladie auto-infligée par des habitudes alimentaires et de consommation d’alcool excessive… quand on sait depuis quelques années que la cause est avant tout génétique4.
La prise en charge de la maladie a deux volets : le premier est de contrôler la réaction inflammatoire épisodique à la présence permanente de cristaux d’urate et la seconde est de faire disparaître les cristaux d’urate quelle que soit leur quantité initiale, pour ainsi éteindre définitivement la maladie. Cette prise en charge a été codifiée pour la première fois en France en 2020 par un groupe de travail de la Société Française de Rhumatologie5,6. Pour la prise en charge de la crise, le traitement repose sur l’utilisation de la colchicine jusqu’à 1,5 mg/jour au maximum, ou 30 à 35 mg/jour de prednisone, le temps de la crise.
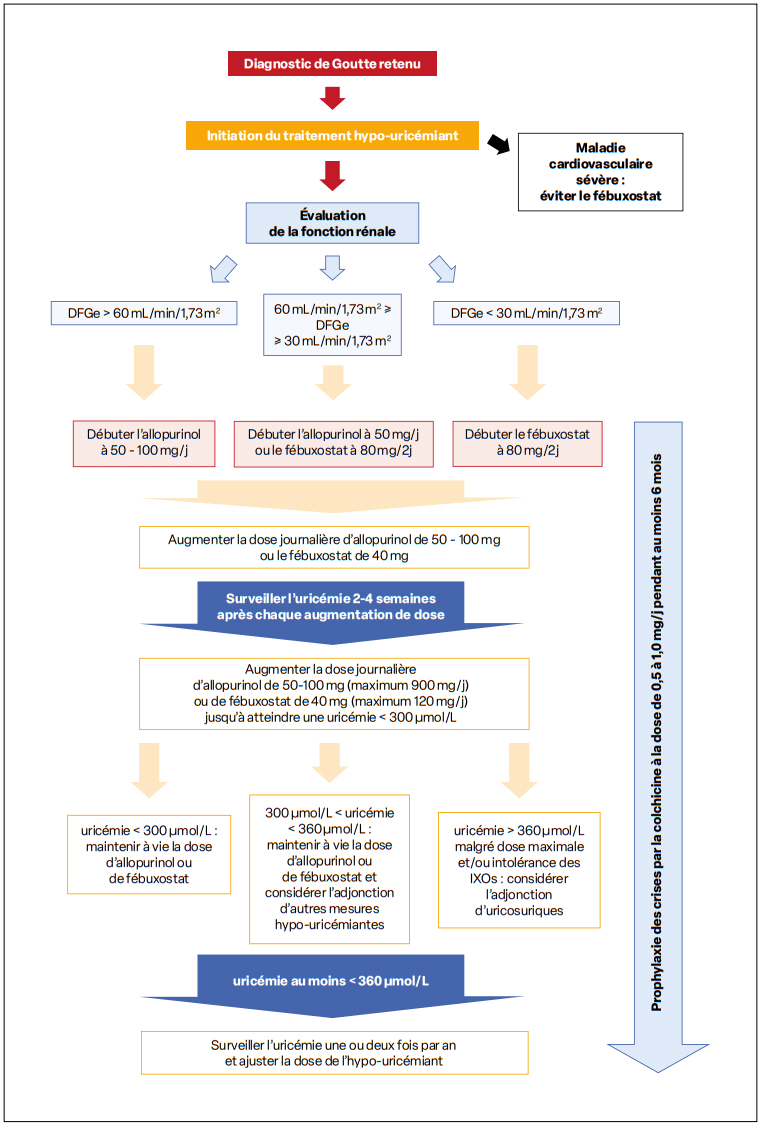
Figure 1 : Prise en charge de fond de la goutte selon la Société Française de Rhumatologie (2020) (d’après Pascart T et coll., Rev Rhum, 2020; 87: 332-341).
Les anti-inflammatoires non stéroïdiens sont en théorie utilisables, mais avec précaution chez des patients atteints de goutte qui, fréquemment, sont aussi affectés d’autres pathologies cardiovasculaires, rénales et métaboliques6. Pour le traitement de fond, le principe est d’inverser le processus chimique qui a conduit, par la saturation plasmatique, de l’urate soluble à la production de cristaux d’urate monosodique, responsables des manifestations cliniques de la maladie. L’objectif va donc être d’abaisser l’uricémie en dessous de 300 μmol/L (50 mg/L) pour interrompre toute nouvelle cristallisation et obtenir la dissolution des cristaux existants.
Les traitements de première intention, l’allopurinol (et le fébuxostat en cas d’insuffisance rénale), vont inhiber la xanthine oxydase et empêcher la production d’urate. Pour que ces traitements soient efficaces, il est essentiel qu’ils soient prescrits (et pris) à doses suffisantes pour obtenir ce taux d’urate sanguin (uricémie) cible, sans quoi les traitements ne servent pas à grand-chose. Une étude britannique a ainsi montré que la dose moyenne d’allopurinol pour atteindre cette cible était de 400 mg/jour, bien loin des 100-200 mg/jour habituellement prescrits7.
La phobie collective autour des risques allergiques (des réactions cutanées effectivement extrêmement sévères) de l’allopurinol doit être vaincue de manière rationnelle, car nous savons que ce risque existe uniquement en début de traitement et disparaît totalement au-delà de 6 mois… et qu’il n’y a ensuite plus de raison de limiter la dose d’allopurinol qui peut être montée jusqu’à 900 mg/jour si la cible d’uricémie l’impose ! Nous savons aussi que les facteurs de risque de ces réactions cutanées sévères sont :
- L’origine ethnique (Chinois Han notamment),
- La présence d’une insuffisance rénale sévère (< 30 mL/min/1,73m2 de débit de filtration glomérulaire),
- La prise de diurétiques,
- Ainsi que des doses initiales élevées d’allopurinol.
Ces facteurs et le risque initial de majoration de crises de goutte justifient de débuter le traitement à petites doses (50–100 mg/j) et d’augmenter progressivement de manière mensuelle les doses jusqu’à obtention de la cible d’uricémie et de s’y maintenir (Figure 1)5.
En appliquant ces règles simples, la quasi-totalité des patients atteints de goutte, y compris ceux avec les tophus les plus impressionnants, viendront à bout de leur maladie. Une prophylaxie du risque initial de crise de goutte justifie la prescription, au moins les 6 premiers mois, d’un traitement quotidien par la colchicine (1 ou 0,5 mg/jour).
CE QUE NOUS FERONS
Les développements actuels cherchent à étoffer l’arsenal thérapeutique dans les rares formes de la maladie difficiles à traiter sur le plan inflammatoire et/ou avec une uricémie difficile à abaisser. Des traitements biologiques visant l’interleukine-1, cytokine très inflammatoire et produite de manière explosive dans la crise de goutte, ont été développés (anakinra, canakinumab) et d’autres sont en développement, pour usage spécialisé. D’autres traitements de fond hypo-uricémiants vont venir étoffer la pharmacopée, cherchant à empêcher la production d’urate ou en favoriser son élimination rénale. L’imagerie devrait occuper une place grandissante dans la prise en charge, afin de suivre la déplétion des stocks de cristaux uratiques et ainsi s’assurer de la rémission complète de la maladie.
CHONDROCALCINOSE ARTICULAIRE
CE QUI CHANGE
La (mé)connaissance de la maladie
Pathologie historiquement méconnue et donc négligée, la chondrocalcinose articulaire (ou rhumatisme à cristaux de pyrophosphate de calcium) est pourtant très certainement la cause la plus fréquente d’arthrite aiguë ou chronique chez les personnes de plus de 60 ans8.
De présentation clinique hétérogène, le spectre de la maladie s’étend de crises aiguës dites pseudo-goutteuses parfois récurrentes, à des arthrites persistantes pouvant mimer des polyarthrites rhumatoïdes du sujet âgé ou des pseudopolyarthrites rhizoméliques, ou tout simplement de l’arthrose (Figure 2).
Comme dans la goutte, la cause des symptômes de la maladie est le cristal, en l’occurrence de pyrophosphate de calcium. Ces cristaux sont susceptibles de se déposer un peu partout dans les structures articulaires notamment, avec une préférence pour les genoux, poignets, articulations acromio-claviculaires, ou encore le rachis avec l’atteinte en « dent couronnée » entre les deux premières vertèbres cervicales (du ligament rétro-odontoïdien). Les causes de la formation de ces dépôts de pyrophosphate de calcium restent méconnues ; de même on ne sait pourquoi ils ne deviennent symptomatiques que chez certaines personnes, alors qu’ils sont présents chez 30 % à 50 % des sujets de plus de 80 ans.
L’imagerie essentielle au diagnostic
Comme dans la goutte, les crises de chondrocalcinose sont de présentation caractéristique le plus souvent, se manifestant de manière brutale, intense et inflammatoire localement. Les localisations atteintes vont différer de la goutte, avec une atteinte majoritaire dans la forme aiguë au genou, poignet, cheville, ou même cervicale avec le syndrome de la dent couronnée se présentant comme une cervicalgie aiguë très inflammatoire (Figure 3).
Pour ces crises, la ponction articulaire peut permettre, comme dans la goutte, d’identifier les cristaux en microscopie en lumière polarisée et par la même occasion de confirmer après mise en culture l’absence d’arthrite septique. Bien plus que dans la goutte, l’imagerie est essentielle pour identifier des dépôts de cristaux de pyrophosphate9.
Dans les formes aiguës, son apport sera moins vital que dans les formes chroniques de présentation clinique moins caractéristiques et souvent sans liquide articulaire accessible à la ponction et donc à l’analyse de certitude. La radiographie standard manque de sensibilité, mais va permettre de mettre en évidence des signes caractéristiques de chondrocalcinose notamment aux genoux et aux poignets (même non symptomatiques).
Les articulations symptomatiques doivent également être radiographiées. Des signes indirects d’arthrose d’articulations habituellement non affectées par l’arthrose sont également évocateurs (poignets, articulations métacarpo-phalangiennes)8. L’utilisation de l’échographie articulaire, souvent considérée comme l’extension de l’examen clinique du rhumatologue, de bien meilleure sensibilité pour identifier les dépôts de cristaux de pyrophosphate de calcium que la radiographie standard, est actuellement grandissante pour le diagnostic. Son utilisation permet ainsi de « rattraper » des dépôts non vus en radiographie, pour ainsi aider au diagnostic(8).
Traitement de la crise
Contrairement à la goutte, nous ne savons pas aujourd’hui dissoudre ni freiner les dépôts de cristaux de pyrophosphate de calcium. Les seuls recours thérapeutiques actuels visent donc à contrôler la réaction inflammatoire. Le premier essai clinique d’ampleur réalisé dans la chondrocalcinose a été réalisé dans le Nord de la France (COLCHICORT) et s’est intéressé aux deux principaux traitements habituellement utilisés, inspirés de la crise de goutte, pour traiter la crise de chondrocalcinose10.
L’étude a montré la très bonne efficacité (en 48 heures dans 2/3 des cas) de la prednisone 30 mg/jour pendant deux jours et de la colchicine 1,5 mg/jour le premier jour et 1 mg le second. Le meilleur profil de tolérance de la prednisone suggère que son utilisation doit être favorisée en première intention.
Traitement des formes chroniques
Au-delà des difficultés diagnostiques rencontrées pour identifier une chondrocalcinose articulaire chronique, le challenge continue au moment de la prise en charge. Un tour d’horizon européen a montré que l’utilisation de la colchicine quotidienne (0,5 à 1 mg/j) sur le long cours permettait de contrôler les symptômes de 30 % à 50 % des patients de manière significative.
Pour les formes réfractaires, les patients doivent être référés au rhumatologue pour discuter des traitements de seconde intention, parmi lesquels notamment le méthotrexate11.
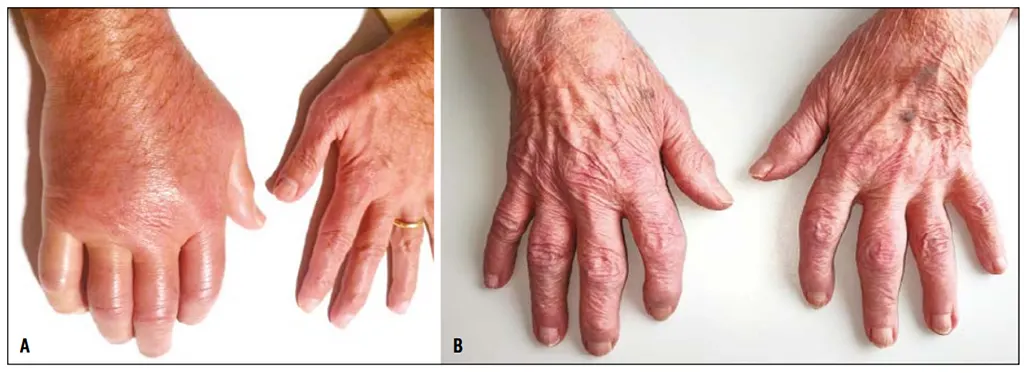
Figure 2 : Aspects cliniques d’une crise de chondrocalcinose du poignet droit (A) et de l’atteinte des mains d’une chondrocalcinose chronique mimant une polyarthrite rhumatoïde tardive (B) (d’après Pascart T et coll., Lancet Rheumatology, 2024; 6(11): e791-e804).
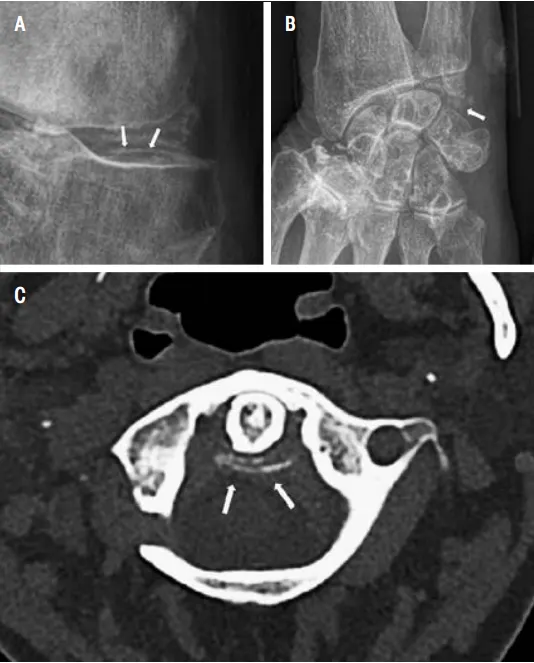
Figure 3 : Aspect de chondrocalcinose (dépôts de cristaux de pyrophosphate de calcium en imagerie). (A) chondrocalcinose des cartilages hyalins et fibrocartilages (ménisque) du genou (flèche), (B) calcification du ligament triangulaire du carpe (poignet) (flèches) et (C) calcification du ligament rétro- odontoïdien ou dent couronnée (flèches) en coupe axiale de scannercervical conventionnel (adaptée de Pascart T et coll., Lancet Rheumatology, 2024; 6(11): e791-e804).
CE QUE NOUS FERONS
L’intérêt scientifique pour la chondrocalcinose est en plein développement depuis 5 ans, après plus d’un demi-siècle de négligence depuis sa découverte. Tous les champs de la maladie sont actuellement activement en cours d’exploration : génétique, épidémiologie, diagnostic, nomenclature, imagerie et traitements. Parmi les traitements, des traitements biologiques sont actuellement à l’essai ou en développement.
Ceux visant l’interleukine-1 évoqués dans la goutte semblent efficaces aussi dans l’inflammation induite par les cristaux de pyrophosphate de calcium. Des traitements inhibant l’interleukine-6, développés et largement utilisés pour la polyarthrite rhumatoïde, sont très prometteurs pour les formes chroniques, avec un essai clinique français actuellement en cours pour le démontrer. Des recherches débutent pour permettre demain de dissoudre les cristaux responsables de la maladie.
Pr Tristan Pascart / Service de Rhumatologie, Hôpital Saint-Philibert, Université Catholique de Lille, Lille.
Liens d’intérêt
L’auteur a reçu des frais de consulting de la part de Novartis,
Amgen, Avalo Therapeutics.
Références
- Dalbeth N, Gosling AL, Gaffo A et coll. Lancet, 2021; 397(10287): 1843-55.
- Pascart T, Filippou G, Liote F et coll. Calcium pyrophosphate deposition disease. Lancet Rheumatol, 2024; 6(12): e791-e804.
- Pascart T, Liote F. Gout: state of the art after a decade of developments. Rheumatology (Oxford), 2019; 58(1): 27-44.
- Major TJ, Topless RK, Dalbeth N et coll. Evaluation of the diet wide contribution to serum urate levels: meta-analysis of population based cohorts. BMJ, 2018;
363:k3951. - Pascart T, Latourte A, Flipo RM et coll. 2020 recommendations from the French Society of Rheumatology for the management of gout: Urate-lowering therapy. Joint Bone Spine, 2020; 87(5): 395-404.
- Latourte A, Pascart T, Flipo RM et coll. 2020 Recommendations from the French Society of Rheumatology for the management of gout: Management of acute flares. Joint Bone Spine, 2020; 87(5): 387-93.
- Doherty M, Jenkins W, Richardson H et coll. Efficacy and cost-effectiveness of nurse-led care involving education and engagement of patients and a treat-totarget urate-lowering strategy versus usual care for gout: a randomised controlled trial. Lancet, 2018; 392(10156): 1403-12.
- Abhishek A, Tedeschi SK, Pascart T et coll. The 2023 ACR/EULAR classification criteria for calcium pyrophosphate deposition disease. Ann Rheum Dis, 2023;
82(10): 1248-57.. - Mandl P, D’Agostino MA, Navarro-Compan V et coll. 2023 EULAR recommendations on imaging in diagnosis and management of crystal-induced arthropathies in
clinical practice. Ann Rheum Dis, 2024; 83(6): 752-9. - Pascart T, Robinet P, Ottaviani S et coll. Evaluating the safety and short-term equivalence of colchicine versus prednisone in older patients with acute calcium
pyrophosphate crystal arthritis (COLCHICORT): an open-label, multicentre, randomised trial. Lancet Rheumatol, 2023; 5(9): e523-e31. - Damart J, Filippou G, Andres M et coll. Retention, safety and efficacy of off-label conventional treatments and biologics for chronic calcium pyrophosphate crystal
inflammatory arthritis. Rheumatology (Oxford), 2024; 63(2): 446-55.