En 2025, il n’y a plus aucun argument solide pour qualifier le HDL-cholestérol de « bon cholestérol » ou de cholestérol cardioprotecteur et cela pour deux raisons principales :
- Des études épidémiologiques de forte puissance ont montré que des taux élevés de HDL-cholestérol sont associés à une augmentation de la mortalité totale et par maladie cardiovasculaire ;
- Il n’a pas été démontré que l’élévation du HDL-cholestérol par un traitement pharmacologique, même en cas de triglycéridémie élevée, même en cas de diabète de type 2, diminue le risque de maladie cardiovasculaire.
CE QUE L’ON PENSAIT SAVOIR
En 1977, une analyse issue du suivi de la cohorte de Framingham1 a montré que plus le taux de HDL-cholestérol (HDL-c) est élevé, moins le risque d’événement coronaire est élevé, donnant naissance au mythe tenace du « bon cholestérol ». Cette notion a été renforcée par les données physiopathologiques indiquant que le HDL-c permet un efflux du cholestérol depuis les artères, contribuant à diminuer les taux de cholestérol dans les plaques athéromateuses.
Quelques autres études, comme le registre PROCAM en Allemagne, ont ensuite fourni des données concordantes avec celles de l’étude de Framingham.
En 2009, une méta-analyse d’études de registres2 a été versée à l’appui de la thèse du « bon cholestérol » en montrant qu’il y a plus d’événements cardiovasculaires (CV) chez les patients ayant un HDL-c bas, par rapport à ceux ayant des valeurs situées dans les valeurs moyennes d’une population. L’analyse détaillée du résultat montrait cependant qu’à partir des valeurs moyennes de HDL-c, la relation entre HDL-c et risque CV prenait un aspect en plateau et donc, qu’un HDL-c élevé n’était pas associé à une diminution du risque CV.
CE QUE L’ON A APPRIS
Les études d’intervention
Plusieurs essais thérapeutiques contrôlés ont été conduits pour évaluer l’effet sur le pronostic clinique de traitements augmentant le HDL-c (fibrates, inhibiteurs de la CETP, acide nicotinique…) et diverses méta-analyses et méta-régressions ont été faites à partir de ces essais. Une seule étude, l’étude VA-HIT évaluant le gemfibrozil, a montré une association entre l’élévation du HDL-c chez des patients ayant un HDL-c bas à l’inclusion et le pronostic CV, sans modification de la mortalité totale. Ce résultat n’a jamais été reproduit dans les autres études disponibles. Ainsi, prises dans leur ensemble sous forme de méta-analyses, ces études n’ont pas montré de bénéfice clinique qui puisse être associé à une augmentation pharmacologique du HDL-c3. De même, il n’a pas été possible d’établir une relation entre la variation du HDL-c sous traitement et une modification du risque coronaire.
Deux hypothèses ont été émises pour expliquer cette déconvenue :
- La première était que ces essais thérapeutiques ne s’étaient pas adressés à la bonne cible et qu’il aurait fallu inclure dans ces études des patients ayant à la fois un HDL-c bas et des triglycérides élevés en sus d’un diabète. Cette hypothèse a été évaluée dans un essai4 spécifiquement conduit pour évaluer un fibrate contre placebo dans une telle population : HDL-c bas, triglycérides élevés et en sus diabète de type 2. Ce fut un échec : il n’y a eu aucune modification du risque CV sous traitement alors que le HDL-c a augmenté et que les triglycérides ont diminué.
- La deuxième hypothèse a été d’envisager qu’augmenter le taux de HDL-c total n’était potentiellement pas la bonne méthode thérapeutique et que l’objectif était que, parmi les différentes sous-formes de HDL-c, il fallait augmenter le HDL-c dit fonctionnel. Cette hypothèse a été évaluée dans un essai thérapeutique contrôlé de forte puissance ayant inclus 18 219 patients et n’a pas montré de bénéfice clinique de l’injection d’un HDL-c fonctionnel5.
Les études d’observation
En 2016, sont parus les résultats de l’étude CANHEART qui vont complètement changer la manière de considérer le HDL-c. Cette étude prospective a suivi plus de 600 000 personnes pendant 5 ans afin d’évaluer la relation entre le taux de HDL-c à l’inclusion et le risque à 5 ans de survenue de quatre événements : la mortalité totale, la mortalité CV, la mortalité par cancer et la mortalité par une autre cause sur l’ensemble de la cohorte et pour chaque sexe6.
Les résultats ont montré qu’il existe une courbe en U entre les taux de HDL-c et le risque de survenue de ces quatre événements, tant chez l’homme que chez la femme (Figure 1). Ainsi, par rapport à un taux de HDL-c dans les valeurs moyennes de la cohorte, un taux bas de HDL-c est associé à un risque augmenté pour tous les événements évalués, mais aussi et surtout, un taux élevé de HDL-c est associé à un taux augmenté de survenue pour ces événements.
Depuis ont été publiées plusieurs études de cohorte sur des populations essentiellement européennes et asiatiques, ayant inclus un nombre très important de personnes, dont l'une de plus de 15 millions7 (Figure 2). Elles arrivent aux mêmes constatations : la relation entre le HDL-c et la mortalité totale ou CV (quelle qu’en soit la cause) prend l’aspect d’une courbe en U ou en J, ces deux événements étant plus fréquents en cas de valeurs de HDL-c basses et élevées. Il en est de même si l’on considère le risque de démence8 ou de fractures9.
Comprendre
Sur le plan épidémiologique, des taux élevés de HDL-c ne sont donc pas associés à un risque moindre d’événements coronaires. Surtout ils sont associés à un risque plus élevé d’événements coronaires, d’événements CV, de mortalité totale et de mortalité par cancer, tant chez l’homme que chez la femme.
Pourquoi alors, avoir constaté et avoir « cru » que le HDL-c pouvait être un bon cholestérol ?
Probablement parce que les études épidémiologiques initiales étaient très imparfaites et notamment manquaient de puissance, en sus d’avoir utilisé des tests statistiques dont on sait maintenant qu’ils renforcent la probabilité d’observer un résultat dit « significatif ».
Ainsi, par exemple, pour reprendre l’étude de 1977 de Framingham, elle a 1) analysé les données de « seulement » 2815 patients qu’elle a réparti en 14 sous-groupes (7 chez l’homme et 7 chez la femme) en fonction de la valeur initiale du HDL-c ; 2) elle n’a totalisé « que » 142 événements et uniquement coronaires dans son résultat et 3) elle n’a pas pris en compte d’autres événements cliniques, même si, un complément de cette étude publié en 1988, a semblé établir une corrélation inverse entre le HDL-c et la mortalité totale. Du fait de la faible population incluse dans cette cohorte, les patients ayant un HDL-c très élevé ont été très peu nombreux et donc le nombre d’événements cliniques dans ce sous-groupe a aussi été faible.
Dans l’étude CANHEART7 , le nombre de patients ayant un HDL-c supérieur à 0,90 a été de 17 944 soit, dans ce seul sous-groupe, plus de 6 fois le nombre de patients analysés dans l’étude de Framingham de 1977. De même, dans CANHEART, il y a été totalisé 17 952 décès totaux, dont 4 658 de cause CV, 6 850 par cancer et 6 444 non dus à un cancer ou une cause CV.
Une étude sud-coréenne qui a inclus 15 859 501 personnes en prévention CV primaire et sans cancer connu8 , suivis pendant 8,8 ans a permis de colliger 108 123 décès cardiovasculaires. L’échelle d’analyse des études parues depuis 2016 est donc complètement différente et beaucoup plus fiable que celle des études plus anciennes.
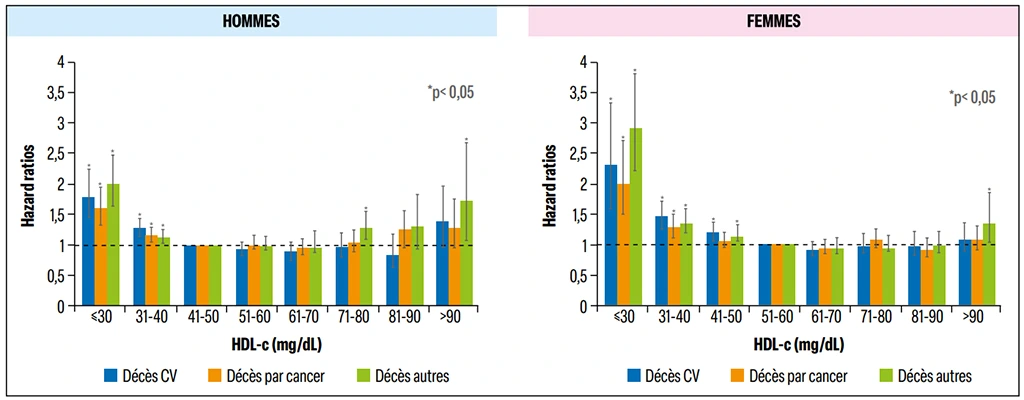
Figure 1 : Relation entre le taux de HDL cholestérol et les taux des décès cardiovasculaires, par cancer ou autre (en hazard ratio ajusté) dans les deux sexes (d’après Ko et coll.6).
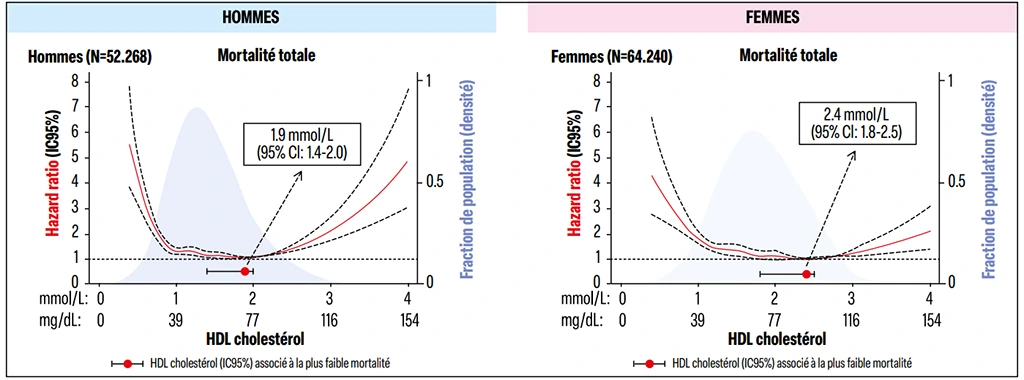
Figure 2 : Relation entre le taux de HDL cholestérol à l’inclusion et le risque de mortalité dans un registre scandinave dans les deux sexes (d’après Masden et coll.10).
Pour ce qui est de la remise en cause de l’hypothèse faisant du HDL-c un bon cholestérol en matière de données physiopathologiques, plusieurs explications complexes ont été avancées10 et il est évoqué soit un problème purement physiopathologique, faisant que le taux élevé de HDL-c ne refléterait pas son caractère fonctionnel, soit le fait qu’un HDL-c élevé a des causes spécifiques, comme l’excès de consommation alcoolisée (Figure 3), la sédentarité entre autres. Ceci ferait donc du HDL-c un marqueur lié à ces facteurs.
Quoi qu’il en soit, il convient de retenir qu’en matière médicale, la physiopathologie est une donnée nécessaire notamment pour envisager l’effet que pourrait avoir une action thérapeutique, mais qu’il s’agit d’une donnée insuffisante pour garantir le bénéfice de l’action thérapeutique envisagée.
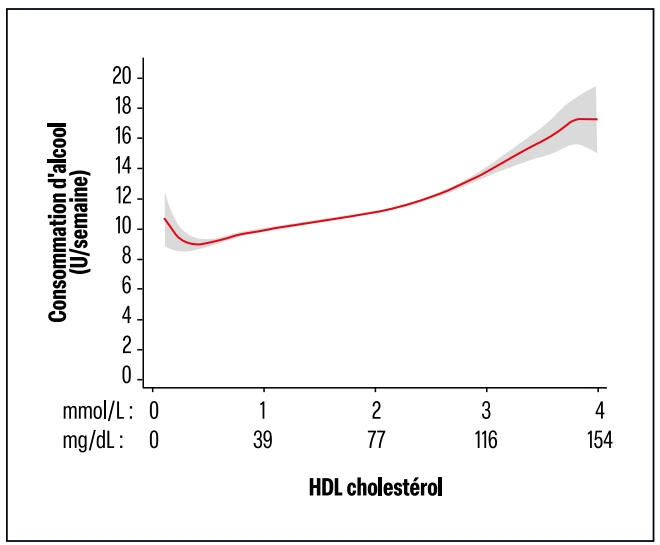
Figure 3 : Relation entre la valeur du HDL-c et la quantité d’alcool consommée évaluée en unités par semaine (d’après Masden et coll.10).
La première chose à faire dans cette remise en cause complète est de reconnaître que l’on ne sait plus parfaitement comment considérer le HDL-c dans l’analyse d’un bilan lipidique. On ne sait pas pourquoi des taux bas comme des taux élevés sont associés à des risques plus élevés de décéder de causes diverses par rapport à des taux moyens. Il est toutefois démontré, et cela n’a jamais été remis en question, que des valeurs basses de HDL-c sont associées à une augmentation du risque CV et que l’augmentation du HDL-c par un traitement en cas de HDL-c bas n’améliore pas le pronostic, alors que l’abaissement du LDL-cholestérol dans ce cas-là améliore le pronostic CV.
La deuxième chose, impérative et indispensable, est de ne plus qualifier le HDL-c de bon cholestérol. Par extension, il ne faut pas dire à un patient « votre risque CV est faible ou est moindre car votre taux de HDL-c est très élevé » ou « je vais diminuer la dose de votre traitement par statine car votre HDL-c est très élevé », attitude qui d’ailleurs n’a aucun fondement scientifique.
La troisième chose est que, comme écrit plus avant, face à un HDL-c bas, même si les triglycérides sont élevés, même si le patient a un diabète de type 2, il ne faut pas envisager d’augmenter pharmacologiquement le taux de HDL-c en choisissant des traitements comme les fibrates, car cela n’apporte aucun bénéfice clinique4 . Si le HDL-c est bas, le risque CV est nettement plus élevé que s’il est dans les valeurs moyennes et de ce fait, la cible lipidique pour diminuer le risque CV est d’abaisser le LDL-cholestérol et donc d’utiliser une statine en première intention.
La quatrième chose est, corrélativement, que l’on ne sait pas encore quoi faire en cas de HDL-c très élevé : les recommandations de prise en charge n’ont pas encore défini la conduite à tenir dans ce cas, faute d’éléments probants pour envisager une attitude thérapeutique bénéfique. Dans l’absolu, à la lumière des études épidémiologiques, s’il est bien impératif de ne pas considérer cela comme un facteur protecteur, il est très probable qu’il faille considérer cela comme un marqueur de risque CV, mais aussi de cancer. Nous ne disposons cependant pas de grilles de risque adaptées ayant intégré cette donnée ni d’essais thérapeutiques évaluant les effets d’un traitement abaissant le LDL-c chez des patients ayant un HDL-c très élevé.
Conclusion
Dans les études d’observation, par rapport aux valeurs moyennes de HDL-c observées dans une population, des valeurs basses de HDL-c mais aussi des valeurs élevées de HDL-c sont associées à une augmentation de la mortalité totale et par maladie CV.
Le HDL-c ne peut pas et ne doit plus être qualifié de « bon cholestérol ».
Dr François Diévart, Cardiologue, Dunkerque
Liens d’intérêt
Honoraires pour conférences ou conseils ou défraiements pour congrès pour et par les laboratoires Alliance BMS-Pfizer, Amgen, AstraZeneca, Bayer, Bouchara-Recordati, BMS, Boehringer Ingelheim, Novartis, Novo Nordisk, Organon, Pfizer, Sanofi-Aventis France, Servier.
Références
- Gordon T, Castelli WP, Hjortland MC et coll. High density lipoprotein as a protective factor against coronary heart disease. The Framingham Study. Am J Med, 1977; 62(5): 707-14. doi: 10.1016/0002-9343(77)90874-9.
- Emerging Risk Factors Collaboration. Major lipids, apolipoproteins, and risk of vascular disease. JAMA, 2009; 302(18): 1993-2000. doi: 10.1001/jama.2009.1619.
- Keene D, Price C, Shun-Shin MJ et coll. Effect on cardiovascular risk of high density lipoprotein targeted drug treatments niacin, fibrates, and CETP inhibitors: meta-analysis of randomised controlled trials including 117,411 patients. BMJ, 2014; 349: g4379. doi: 10.1136/bmj.g4379.
- Das Pradhan A, Glynn RJ, Fruchart JC et coll. Triglyceride lowering with pemafibrate to reduce cardiovascular risk. NEJM, 2022; 387(21): 1923-1934. doi: 10.1056/ NEJMoa2210645.
- Gibson CM, Duffy D, Korjian S et coll. Apolipoprotein A1 infusions and cardiovascular outcomes after acute myocardial infarction. NEJM, 2024; 390(17): 1560-1571. doi: 10.1056/NEJMoa2400969
- Ko DT, Alter DA, Guo H et coll. High-density lipoprotein cholesterol and cause-specific mortality in individuals without previous cardiovascular conditions: The CANHEART study. J Am Coll Cardiol, 2016; 68(19): 2073-2083. doi: 10.1016/j.jacc.2016.08.038.
- Yi SW, Park HB, Jung MH et coll. High-density lipoprotein cholesterol and cardiovascular mortality: a prospective cohort study among 15.8 million adults. Eur J Prev Cardiol, 2022; 29(5): 844-854. doi: 10.1093/eurjpc/zwab230.
- Kjeldsen EW, Thomassen JQ, Rasmussen IJ et coll. Plasma high-density lipoprotein cholesterol and risk of dementia: observational and genetic studies. Cardiovasc Res, 2022; 118(5): 1330-1343. doi: 10.1093/cvr/cvab164.
- Hussain SM, , Ebeling PR, Barker AL et coll. Association of plasma high-density lipoprotein cholesterol level with risk of fractures in healthy older adults. JAMA Cardiol, 2023; 8(3): 268-272. doi: 10.1001/jamacardio.2022.5124.
- Madsen CM, Varbo A, Nordestgaard BG. Novel insights from human studies on the role of high-density lipoprotein in mortality and noncardiovascular disease. Arterioscler Thromb Vasc Biol, 2021; 41(1): 128-140. doi: 10.1161/ATVBAHA.120.314050. Epub 2020 Nov 24.